Arbeitsgruppe Prof. Dr. Christine Stadelmann-Nessler

Die Arbeitsschwerpunkte der AG Stadelmann-Nessler liegen auf dem Gebiet entzündlich-entmarkender Erkrankungen des zentralen Nervensystems (ZNS), insbesondere der multiplen Sklerose (MS), der Neuromyelitis optica (NMO) und der akuten disseminierten Enzephalomyelitis (ADEM).
Diesen Erkrankungen gemeinsam ist ein Angriff des Immunsystems auf hirneigene Strukturen, was zu Entmarkungsherden (Läsionen) im ZNS und damit zu den typischen Krankheitssymptomen wie Lähmungen, Sensibilitätsstörungen oder Sehstörungen führt. Während die molekularen Zielstrukturen bei NMO und ADEM zum Teil bekannt sind, ist die Ursache für die Demyelinisierung bei der MS noch unklar. Ziel unserer Arbeitsgruppe ist es, die zellulären und molekularen Krankheitsmechanismen von Entmarkungserkrankungen besser zu verstehen.
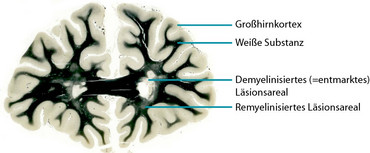
Die Schädigung des ZNS bei entzündlich-entmarkenden Erkrankungen muss allerdings nicht unumkehrbar sein. In den Läsionen werden häufig Reparaturprozesse aktiviert, durch die es zur Neubildung der schützenden Markscheiden um die Axone kommt. Diese regenerativen Prozesse und die Ursachen für die häufig unvollständige Reparatur von Entmarkungsherden sind jedoch noch wenig verstanden und nehmen damit auch einen wesentlichen Bestandteil unserer Forschung ein. Mit den Erkenntnissen unserer Arbeit hoffen wir, Therapieansätze entwickeln zu können, die letztendlich den Patient*innen zu Gute kommen.
Zur Untersuchung dieser Fragestellungen stehen uns in der Arbeitsgruppe zahlreiche experimentelle Modelle zur Verfügung. Des Weiteren können wir auf ein großes Archiv humaner ZNS-Gewebeproben zurückgreifen. Diese sind sowohl für die Entwicklung neuer Theorien und Konzepte von großer Bedeutung als auch für die Validierung unserer experimentellen Ergebnisse.
Aktuelle Projekte
De- und Remyelinisierung von MS-Läsionen
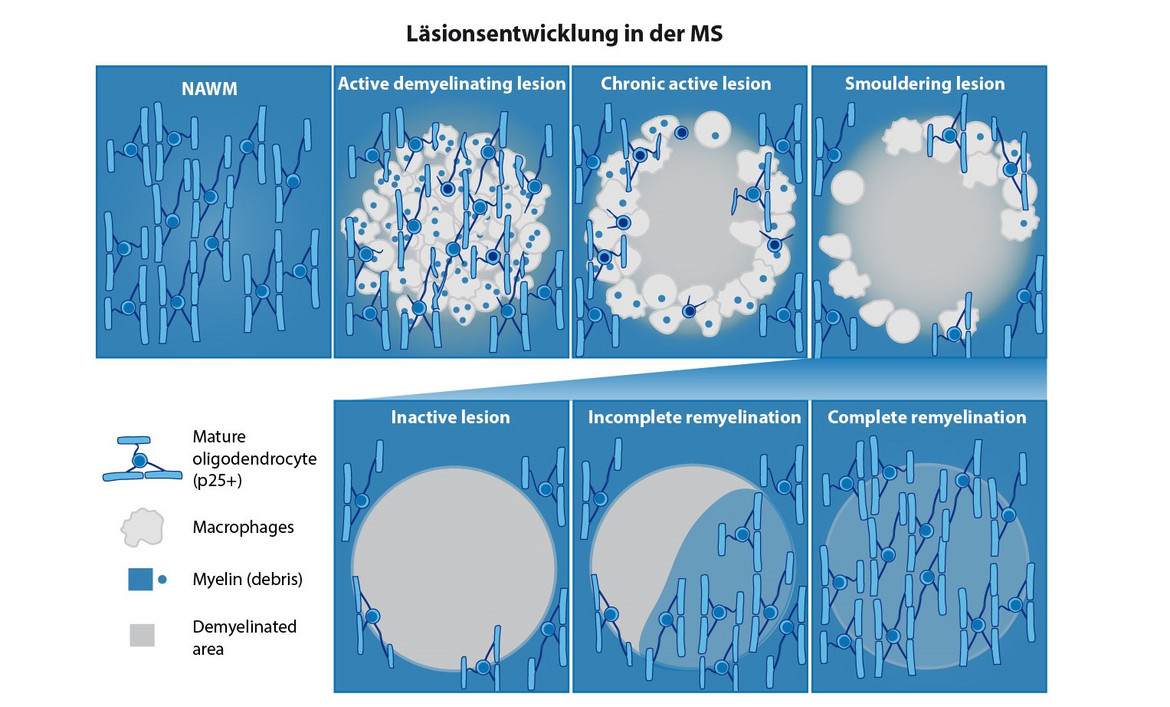
Die MS ist eine chronische entzündliche Erkrankung, bei der es zu umschriebenen Entmarkungsherden im ZNS kommt, die durch den Verlust der Isolierschicht der Nervenfasern (=Myelinscheiden) gekennzeichnet sind. Dieser Prozess wird als Demyelinisierung (=Entmarkung) bezeichnet. Die Wiederherstellung der Myelinscheide um die Axone nennt man Remyelinisierung. Für die Bildung der Myelinscheide sind die Oligodendrozyten verantwortlich, die während des Verlaufs der MS Erkrankung geschädigt werden (Stadelmann et al., 2019; Rodriguez, Wegner et al., 2014; Schultz, van der Meer et al., 2017). Bislang herrschte die Meinung vor, dass die Oligodendrozyten für die Remyelinisierung immer neu aus Oligodendrozytenvorläuferzellen entstehen müssen.
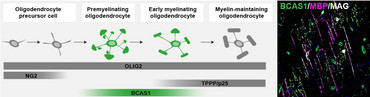
Neuere Daten weisen jedoch darauf hin, dass auch reife Oligodendrozyten in den Läsionen an der Remyelinisierung beteiligt sind (Yeung et al., 2019; Duncan et al., 2018). In unserer Arbeitsgruppe konnten wir vor kurzem das Markerprotein BCAS1 identifizieren, das spezifisch für myelinisierende Oligodendrozyten ist. BCAS1-positive Oligodendrozyten korrelieren sowohl bei der Entwicklung als auch bei der Remyelinisierung zeitlich und örtlich mit der Myelinisierung (Fard, van der Meer et al., 2017). Mit Hilfe dieses Markerproteins können wir nun die Reparaturprozesse im Gehirn bei Entmarkungserkrankungen besser studieren und untersuchen, welche Voraussetzungen erfüllt sein müssen, damit Remyelinisierung erfolgreich stattfinden kann.
Rolle der Mikrogliazellen
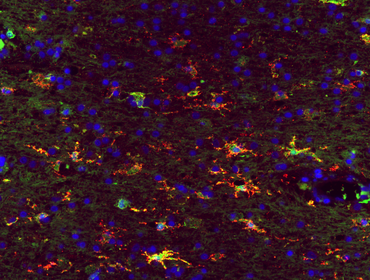
Mikrogliazellen haben vielfältige Funktionen im ZNS. Unter pathologischen Bedingungen können sie durch die Phagozytose geschädigten Zellmaterials und die Erregerabwehr schützende Funktionen ausüben. Andererseits scheinen sie aber auch schädigende autoimmune ZNS Prozesse zu beeinflussen und teilweise zu unterstützen. In verschiedenen Projekten untersuchen wir die Rolle der Mikrogliazellen in Abgrenzung zu peripheren Makrophagen in der Pathogenese idiopathischer entzündlicher Entmarkungserkrankungen (Lagumersindez-Denis, Wrzos, Mack et al., 2017; Masuda, Sankowski, Staszewski et al., 2019).
Auch im physiologischen Zustand spielen Mikroglia für die Homöostase des ZNS eine wichtige Rolle. So sind sie z.B. wichtig für die neuronale Entwicklung und Synapsenmodellierung. Die Auswirkungen einer Störung dieser physiologischen Funktionen von Mikroglia untersuchen wir an ausgewählten Beispielen von erblichen Erkrankungen der weißen Substanz (Leukodystrophien), denen eine primäre Schädigung der Mikrogliazellen in Folge eines genetischen Defektes gemein ist (Bergner et al., 2019).
Neuroaxonale Schädigung bei MS
Besonders bei der MS steht neben den fokalen Entmarkungsherden und dem Oligodendrozytenverlust die neuroaxonale Schädigung im Vordergrund. In unseren Forschungsprogrammen untersuchen wir auch diesen Aspekt der „entzündlichen Neurodegeneration“ – durchaus im Vergleich mit klassischen neurodegenerativen Erkrankungen, wie beispielsweise der Alzheimer Erkrankung (Schirmer et al. 2009; Schirmer et al. 2011; Singh, Dallenga et al., 2017; Schultz, van der Meer et al., 2017; Töpperwien et al. 2018, Lodygin et al. 2019, Töpperwien et al. 2020).
Modelle und Methoden im Labor
Zur Untersuchung der o.g. Fragestellungen sind zahlreiche, z.T. von uns speziell entwickelte experimentelle Modelle im Labor etabliert. Neben aktiv und passiv induzierten Varianten der experimentellen autoimmunen Enzephalomyelitis (EAE) (Singh, Dallenga et al., 2017) kommt ein Modell fokaler entmarkender Läsionen zur Anwendung (Merkler et al., 2006; Lagumersindez-Denis, Wrzos, Mack et al., 2017). An reinen Entmarkungsmodellen steht neben dem Lysolecithin-Injektionsmodell auch das Cuprizon-Modell der toxischen Entmarkung zur Verfügung (Fard, van der Meer et al., 2017). Auch Modelle der Neuromyelitis optica sind in unserer Arbeitsgruppe etabliert (Wrzos et al. 2014; Weil et al., 2016). Zur Analyse dieser Modelle sowie der humanen Gewebeproben kommen modernste morphologische und molekularbiologische Techniken zum Einsatz (z.B. Histochemie und Immunhistologie, qPCR, FACS). Zusätzlich erarbeiten wir in Zusammenarbeit mit dem Institut für Röntgenphysik der Universität Göttingen (Direktor: Prof. Dr. Tim Salditt) neue Methoden der dreidimensionalen Darstellung von gesundem und pathologisch verändertem Gewebe. So gelang es uns mit Hilfe der Phasen-Kontrasttomografie pathologische Veränderungen bei der Alzheimer Erkrankung an ungefärbten Gewebeproben dreidimensional zu visualisieren (Töpperwien et al. 2018; Töpperwien et al. 2020).
Förderung
Unsere Forschung wird und wurde (in den letzten 3 Jahren) durch die Deutsche Forschungsgemeinschaft (DFG), die gemeinnützige Hertie-Stiftung, die deutsche MS-Gesellschaft (DMSG) und die National Multiple Sclerosis Society USA (NMSS) gefördert. Wir erhalten zudem Forschungsgelder im Rahmen des transregionalen Sonderforschungsbereichs SFB/TRR 274 „Checkpoints in der Regeneration des zentralen Nervensystems“, an dem Forscher*innen aus München und Göttingen mitwirken.
Alumni
- Doron Merkler
- Monika Albert
- Angelika Escher
- Robert Böscke
- Lucas Schirmer
- Enrique Garea Rodriguez
- Shanu Roemer
- Tobias Dallenga
- Nielsen Lagumersindez Denis
- Shailender Singh
- Patrik Kunz
- Alonso Barrantes Freer
- Erika Avendaño Guzmán
- Claudia Wrzos
Kontakt

Kontaktinformationen
- Telefon: +49 551 3967575
- Telefax: +49 551 3910800
- E-Mail-Adresse: neuropat(at)med.uni-goettingen.de
Das könnte Sie auch interessieren